2017年將在美國上市的10大醫療設備
新的一年到來,也意味著一連串新型醫療設備將在美國出現。被寄予厚望的產品包括糖尿病設備、新式經導管主動脈瓣,以及新型手術機器人系統。在此盤點今年患者期待看到的美國10大醫療設備。
NO.1 波科公司的Lotus Edge

波科公司的新一代經導管主動脈瓣Lotus Edge預計將在2017年第四季度獲得FDA認證。這款新型瓣膜可以進行再定位和再回收,早期數據已經顯示出瓣周漏和永久起搏器植入的低發生率。
REPRISE III實驗對Lotus Edge和美敦力的CoreValve進行了比較,這些數據有望在2017年5月公布。這一實驗數據將用于瓣膜21-、23-25、27-mm型號在第四季度獲得FDA批準。29-mm型號預計晚些獲得批準。
截止2017年1月4日,這款產品尚未獲得美國FDA監管部門的批準或認可。
NO.2 波科公司的Vercise腦深部刺激系統
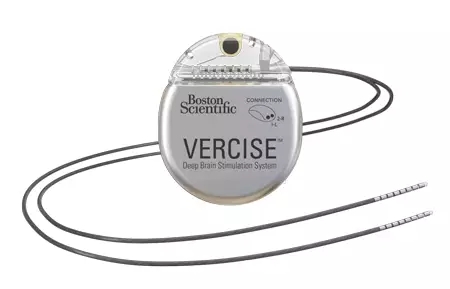
波科公司的Vercise腦深部刺激(Deep Brain Stimulation,DBS)系統正在針對帕金森綜合征在美國進行試驗。神經調節系統在歐洲已經用于包括帕金森病、特發性震顫、主要和次要肌張力障礙等適應癥。
管理層述評波科公司2016年第三季度收入時,重申將在2017晚些時候在美國推出Vercise。
截止2017年1月4日,這款產品尚未獲得美國FDA監管部門的批準或認可。
NO.3 強生公司的OneTouch Via

用于胰島素按需給量的OneTouch Via系統,早些時候,當這項技術屬于Calibra Medical公司時,就獲得了FDA批準。目前,Calibra Medical是一家屬于強生的糖尿病護理公司。該設備是一種可穿戴設備,用于胰島素控制給量。OneTouch公司及強生糖尿病護理公司北美區域高級管理人員Bridget Kimmel表示,2016年11月下旬,已經向FDA重新提交了有關該設備更新生產流程的510(k)申請。她希望今年上半年OneTouch Via可以在美國市場面世。
截止2017年1月4日,這款產品尚未獲得美國FDA監管部門的批準或認可。
NO.4 美敦力的MiniMed 670G系統
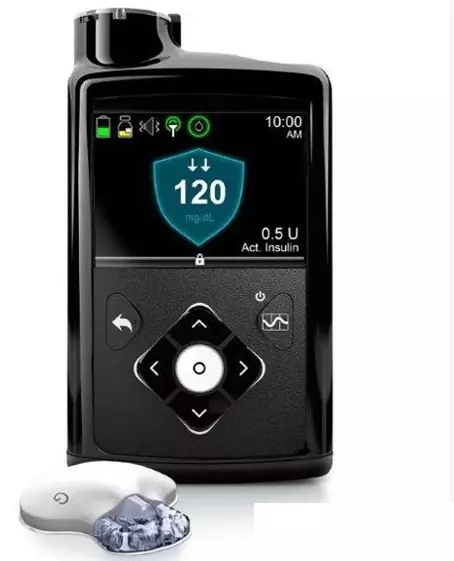
美敦力的MiniMed 670G是第一個用于胰島素給藥的混合閉環系統,被稱為第一個人工胰島素,2016年9月獲得了FDA批準。該系統旨在幫助患者在血糖水平合理范圍之內獲得最大化自由時間。
FDA批準來得比預期的時間要早一些,美敦力計劃2017年春季在美國市場推出這一系統。
NO.5 美敦力的Resolute Onyx藥物洗脫支架
藥物洗脫支架(Drug-eluting stent,DES)巨頭美敦力公司期望可以在最近一個財年(4月底)結束前在美國市場發布Resolute Onyx DES。Resolute Onyx已經于2014年11月獲得了歐洲CE認證,2016年2月增加了其他尺寸和適應癥。截止2017年1月4日,這款產品尚未獲得美國FDA監管部門的批準或認可。
新的一年到來,也意味著一連串新型醫療設備將在美國出現。被寄予厚望的產品包括糖尿病設備、新式經導管主動脈瓣,以及新型手術機器人系統。在此盤點今年患者期待看到的美國10大醫療設備。
NO.6 Neuronix Medical公司的neuroAD治療系統
據NeuroNews報道,Neuronix Medical的neuroAD治療系統預計在2017年拿到FDA認證。這款設備旨在幫助阿爾茨海默病患者,將經顱脈沖磁刺激(Transcranial Magnetic Stimulation ,TMS))與認知訓練相結合,改善患者的認知能力。
neuroAD治療系統已經在歐洲上市。截止2017年1月4日,這款產品尚未獲得美國FDA監管部門的批準或認可。
NO.7 圣猶達公司的HeartMate 3左心室輔助系統

圣猶達公司2015年10月收購 Thoratec之后,仍繼續對Thoratec的HeartMate 3左心室輔助技術進行持續開發。最新一代的HeartMate 3左心室輔助系統(HeartMate 3 Left Ventricular Assist System ,LVAS)已經獲得CE認證,正在進行MOMENTUM 3 IDE臨床實驗。2016年11月曾公布了該實驗6個月內的跟蹤數據。
目前在公開領域沒有看到有關HeartMate 3上市時間安排的消息,不過2016年2月該公司投資者曾表示,管理層承諾2016年下半年向FDA提交短期數據。如果批準時間預計需要12個月,那么這款設備有望在2017年底獲得FDA認證。
截止2017年1月4日,這款產品尚未獲得美國FDA監管部門的批準或認可。
NO.8 圣猶達公司可用于磁共振的ICDs和CRT-Ds

在2016年10月第三季度財報電話會議上,公司管理層向分析師表示,2016年第四季度將向FDA提交MRI安全性高壓器件的文件。預計將在2017年上半年獲得FDA認證。
公司在2016年2月投資者報告日上曾表示,如果成功獲得FDA認證,那么代表磁共振安全的標志將可以用于現有的Ellipse和Fortify Assura ICDs,以及Quadra Assura CRT-D。
截止2017年1月4日,這款產品尚未獲得美國FDA監管部門的批準或認可。
NO.9 史賽克用于MAKO系統的Triathlon全膝關節
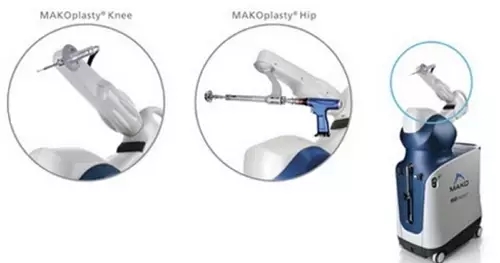
史賽克公司用于Mako Robotic系統的Triathlon全膝關節(Triathlon Total Knee)已經獲得FDA認證。
據2016年的報道,雖然FDA在2015年8月已批準使用Triathlon 全膝關節的Mako系統,不過公司決定推遲到2017年再讓產品上市,目的是為了優化患者體驗。預計在2017年春季會隆重發布。
NO.10 TransEnterix公司的Senhance外科機器人系統
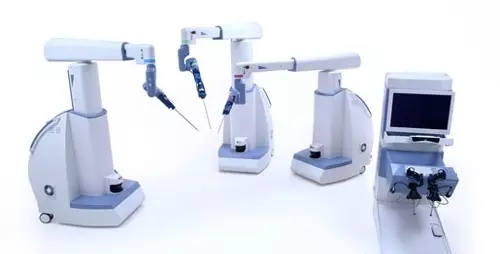
TransEnterix 公司的關注點從SurgiBot系統轉向Senhance外科機器人系統(之前命名為ALF-X系統)。據報道,該產品的可用性研究已經完成,該公司計劃在2017年初提交510(k)文件。
預計2017年Senhanc將獲得FDA認證。截止2017年1月4日,這款產品尚未獲得美國FDA監管部門的批準或認可。
【來源: 科訊醫療網】

相關閱讀
- 國內血管介入手術機器人賽道迎來“黃金時段”2022-11-02
- 支氣管鏡手術機器人開啟肺部疾病診療賽道新篇章2022-03-02
- 最新排名出爐:2020全球頂級醫療企業TOP102021-02-05
- 21省耗材帶量采購:美敦力、雅培、微創、樂普…2021-01-14
- 知名械企分食170億市場:美敦力、史賽克、威高...2021-01-12