解讀10月1日施行的醫療器械新五法
國家食品藥品監督管理總局圍繞《醫療器械監督管理條例》,制修訂了《醫療器械注冊管理辦法》、《體外診斷試劑注冊管理辦法》、《醫療器械說明書和標簽管理規定》、《醫療器械生產監督管理辦法》、《醫療器械經營監督管理辦法》等五部規章,已于2014年10月1日施行。五箭齊發,醫療器械全程系統性監管體系形成,五部規章核心要點是什么?新舊版之間有何差異?小編為您逐一解讀。
表1 《醫療器械注冊管理辦法》解讀
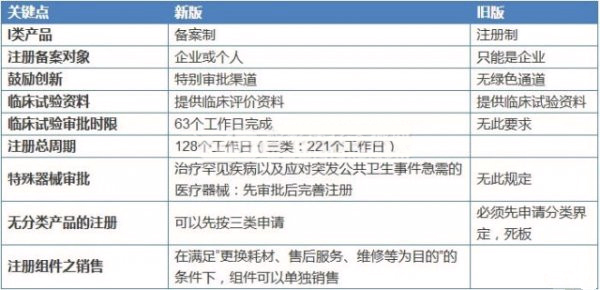
表2 《體外診斷試劑注冊管理辦法》解讀
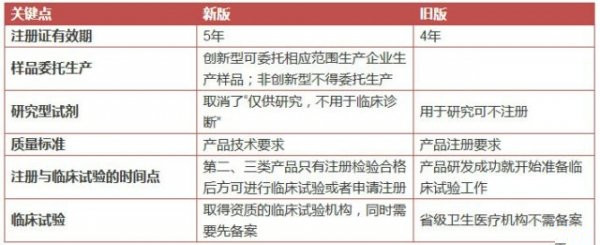
表3 《醫療器械生產監督管理辦法》解讀
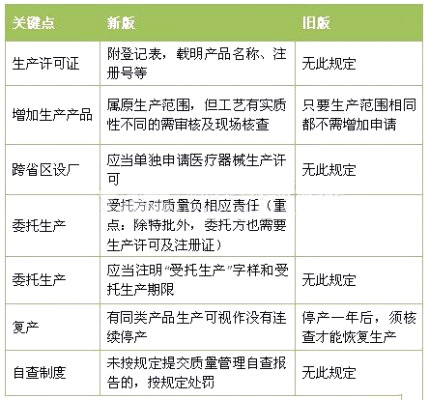
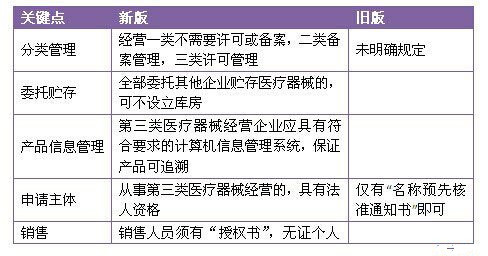
表4 《醫療器械經營監督管理辦法》解讀
《醫療器械說明書和標簽管理規定》解讀
新規定由10號令的23條,變更為6號令19條,但要求并沒有減少,而罰則更清晰,刪除一些重復的內容,描述更準確。主要變化包括:
新的規章參考國際慣例,將“包裝標識”與“標簽”合并為“標簽”,避免了術語之間的交叉混淆。
對于重復使用的醫療器械,新規章明確了管理要求。
對消費者個人增加了要求,明確由消費者個人自行使用的醫療器械還應當具有安全使用的特別說明。
對于說明書和標簽所用名詞術語和顏色符號等,新規章也予以了規范。
第一類醫療器械實施備案管理已備案的醫療器械,備案信息表中登載內容、備案產品技術要求以及說明書其他內容發生變化的,備案人可自行修改說明書和標簽的相關內容。
附加:CFDA日前發布禁止委托生產醫療器械目錄
一、部分植入材料和人工器官類醫療器械
1.血管支架、血管支架系統(外周血管支架除外);
2. 心臟封堵器、心臟封堵器系統;
3. 人工心臟瓣膜;
4.整形植入物(劑)。
二、同種異體醫療器械
三、部分動物源醫療器械
1.心臟、神經、硬腦脊膜修補材料;
2.人工皮膚;
3.體內用止血、防粘連材料;
4. 骨修復材料;
5.其他直接取材于動物組織的植入性醫療器械。
四、其他
1.心臟起搏器;
2.植入式血泵;
3.植入式胰島素泵。

相關閱讀
- 總局印發食品藥品安全監管信息公開管理辦法2017-12-28
- 大放開!醫械臨床試驗機構,不用審批了!2017-08-07
- 2017下半年CFDA的五大工作重點2017-08-01
- 2016年CFDA批準了45項創新醫療器械2016-12-09
- CFDA等六部委發文推進醫藥工業發展規劃2016-11-08